Para comprender de forma completa el comportamiento de las sustancias puras es necesario tener en cuenta los diagramas de propiedades. Estos diagramas son tres: el diagrama Temperatura vs. Volumen específico (T-v), el diagrama Presión vs. Volumen específico (P-v) y el diagrama Presión vs. Temperatura (P-T).
Estos diagramas son extraídos de las proyecciones sobre los planos que determinan los ejes de las llamadas superficies P-v-T. Y se dice superficies por el simple hecho de que no es una sino dos, la superficie para una sustancia que se contrae al congelarse y la superficie para la sustancia que se expande al congelarse.
Como es de esperarse, los diagramas varían de acuerdo a si la sustancia se contrae o se expande cuando se congela, pero de dichas variaciones se hablará más adelante.
Diagrama T-v
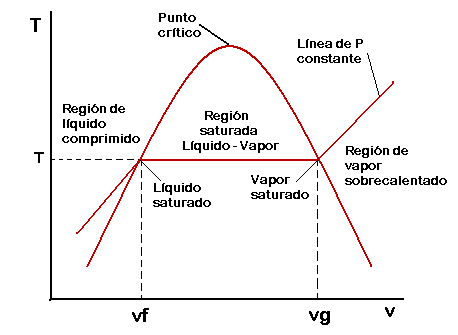
En este diagrama se pueden apreciar inicialmente tres regiones: la región de líquido comprimido, que es la región a la izquierda de la campana, la región de vapor sobrecalentado que es región a la derecha de la campana y la región de Líquido + Vapor saturados que es aquella que se halla dentro de la campana. La que se encuentra marcada como línea de P constante es toda la línea que comienza en la región de líquido comprimido, pasa por dentro de la campana y termina en la región de vapor sobrecalentado. No es solo el último segmento sino la línea completa.
Nótese el carácter ascendente que tiene la línea de presión constante de izquierda a derecha, ya que en el diagrama P-v, ésta no sube sino que baja.
A la línea que pertenece a la campana y baja hacia la izquierda del punto crítico la podemos llamar línea de líquido saturado, y a la línea que baja hacia la derecha del punto crítico la podemos llamar línea de vapor saturado.
Es importante mencionar que la campana está formada por los puntos de líquido saturado y de vapor saturado de infinitas líneas de presión constante, de modo que el que se presenta en el gráfico es solo un caso particular a cierta T y P determinadas.
Diagrama P-v
En comparación con el diagrama T-v, este diagrama tiene dos grandes diferencias. La primera es que la línea que era de presión constante pasa a ser una línea de temperatura constante, y la segunda, que dicha línea desciende de izquierda a derecha en lugar de ascender.
Diagrama P-T

Este diagrama también se conoce como diagrama de fase porque es posible identificarlas al estar separadas por tres líneas. La línea de sublimación es la que separa la fase sólida de la fase vapor, la de vaporización separa la fase líquida de la fase vapor y la línea de fusión separa la fase sólida de la fase líquida. Nótese que hay una desviación en la línea de fusión dependiendo de si la sustancias se expande o se contrae al congelarse.
Las tres líneas antes mencionadas convergen en el punto triple, el cual es el estado en el cual las tres fases de una sustancia pueden coexistir en equilibrio, es un estado donde se puede tener hielo, líquido y vapor al mismo tiempo.





Comentarios potenciados por CComment