Un recipiente rígido cerrado contiene agua a 100ºC y el volumen total de líquido es una décima parte del volumen total de vapor. Se calienta hasta que la presión alcanza 2 MPa.
Calcular la temperatura final y la cantidad de calor requerido por unidad de masa para llevar a cabo este proceso.
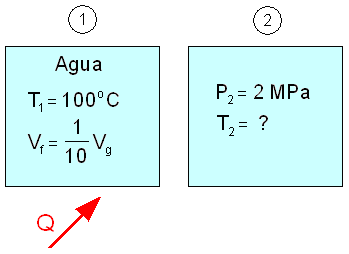
Solución
El volumen total es igual al volumen total de líquido más el volumen total de vapor:
\[ V = V_f + V_g \]
\[ V = \frac{1}{10} V_g + V_g \]
\[ V = \frac{11}{10} V_g = 1.1 V_g~~~\text{Ec. 1} \]
La masa total es igual a la masa total de líquido más la masa total de vapor:
\[ m = m_f + m_g \]
Pero la masa es igual al volumen total sobre el volumen específico:
\[ \frac{V}{v} = \frac{V_f}{v_f} + \frac{V_g}{v_g}~~~\text{Ec. 2} \]
Reemplazando Ec. 1 en Ec. 2:
\[ \frac{1.1 V_g}{v} = \frac{V_f}{v_f} + \frac{V_g}{v_g} \]
\[ \frac{1.1 V_g}{v} = \left( \frac{1}{10} \right) \frac{V_g}{v_f} + \frac{V_g}{v_g}\]
\[ \frac{1.1}{v} = \frac{0.1}{v_f} + \frac{1}{v_g} \]
\[ \frac{1}{v} = \left( \frac{1}{1.1} \right) \left( \frac{0.1}{v_f} + \frac{1}{v_g} \right) \]
Estado 1:
|
T1=100°C
Líquido+Vapor
|
vf=0.001044 m3/kgm
vg=1.6729 m3/kgm
uf=418.91 kJ/kgm
ufg=2087.6 kJ/kgm
|
\[ \frac{1}{v} = \left( \frac{1}{1.1} \right) \left( \frac{0.1}{0.001044} + \frac{1}{1.6729} \right) \]
\[ \frac{1}{v} = 87.621~\frac{kgm}{m^3} \]
\[ v = 0.011413~\frac{m^3}{kgm} \]
También,
\[ x_1 = \frac{v_1-v_f}{v_{fa}} = \frac{0.011413-0.001044}{1.6729-0.001044} = 0.0062\]
\[ u_1 = u_f + x_1 \left( u_{fg} \right) \]
\[ u_1 = 418.91 + (0.0062)(2087.6) \]
\[ u_1 = 431.85 \frac{BTU}{lbm} \]
Estado 2
|
P2=2 MPa
v2=v1=0.011413
|
vf=0.001177 m3/kgm
vg=0.09963 m3/kgm
uf=906.42 kJ/kgm
ufg=1693.8 kJ/kgm
|
La temperatura en el estado final será la temperatura de saturación a 2 MPa.
\[ T_2 = 212.42°C \]
Luego,
\[ x_2 = \frac{v_2-v_f}{v_{fg}} = \frac{0.011413-0.001177}{0.09963-0.001177} = 0.10397 \]
\[ u_2 = u_f + x_2 \left( u_{fg} \right) \]
\[ u_2 = 906.42 + (0.10397)(1693.8) \]
\[ u_2 = 1082.52 \frac{BTU}{lbm} \]
Al plantear la 1a ley de la termodinámica:
\[ {}_1q_2 = u_2 - u_1 + {}_1w_2~~~~~~({}_1w_2=0) \]
\[ {}_1q_2 = 1082.52 - 431.85 \]
\[ {}_1q_2 = 650.67 \frac{kJ}{kgm} \]





Comentarios potenciados por CComment